Исследователи из Сколтеха и Техасского университета в Остине (США) представили экспериментально подтвержденную концепцию носимого датчика, который способен через повязку отслеживать процесс заживления ран, язв и других хронических повреждений кожи. Результаты исследования опубликованы в журнале ACS Sensors.
Плохо заживающие хронические раны на коже, такие как язвы на ногах при диабете или пролежни, крайне сложно поддаются лечению и вызывают серьезный дискомфорт у пациентов. Для контроля за процессом заживления и подбора необходимого лечения врачам и медсестрам приходится снимать повязку, при этом повреждаются уже восстановившиеся участки кожного покрова, а у пациента возникают болезненные ощущения. Кроме того, это требует повторных визитов к врачу для предотвращения инфицирования раны. Визуального осмотра раны зачастую бывает недостаточно, поэтому приходится использовать другие методы обследования, такие как биопсия, мазки с поверхности раны или анализ на наличие патогенов. Все эти дорогостоящие инвазивные процедуры могут занимать не один день и при этом не давать нужной информации для выбора стратегии лечения.
В центре внимания разработчиков медицинской техники сейчас находится технология «умных» повязок, которые представляют собой носимые датчики, способные отслеживать уровень биомаркеров в процессе заживления раны. Группа исследователей из России и США под руководством первого проректора Сколтеха профессора Кита Стивенсона исследовала электроаналитические методы, имеющие широкие перспективы клинического применения благодаря их относительной простоте, чувствительности, надежности и ряду других преимуществ.
«На начальных этапах исследования нам удалось описать характеристики и продемонстрировать высокую чувствительность и селективность датчика при анализе множества компонентов в сложных биологических смесях, имитирующих реальную биологическую среду», − рассказывает профессор Стивенсон.
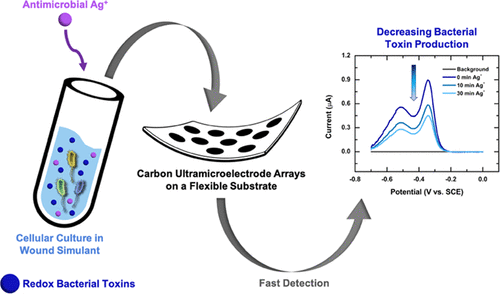
Для целей исследования ученые разработали прототип электроаналитического датчика на основе углеродных ультрамикроэлектродных решеток (CUA) на гибких подложках. Если в предыдущих работах датчик устанавливался на кварцевую подложку, то в данном исследовании авторы разработали специальный метод для размещения решеток на подложке из полиэтилентерефталата (ПЭТ) для повышения гибкости датчика.
Исследователи также разработали модель естественной биологической среды вокруг раны, с помощью которой проверяли чувствительность датчика к трем основным биомаркерам: пиоцианин, который вырабатывается бактерией Pseudomonas aeruginosa, образующей колонии в области хронических ран; оксид азота (NO*), который клетки иммунной системы продуцируют для защиты от бактериальных инфекций; мочевая кислота – продукт метаболизма, уровень которого напрямую связан с тяжестью повреждения. Все эти соединения являются электроактивными: это означает, что они реагируют на электрическую активность и могут быть обнаружены электроаналитическим датчиком.
В ходе тестирования было показано, что порог чувствительности и линейный динамический диапазон датчика, т.е. диапазон, в котором датчик выдает значимые количественные результаты, соответствуют диапазону биологически обоснованных концентраций. Это означает, что устройства на основе таких датчиков можно использовать в клинических условиях для контроля за заживлением ран. Исследователи также протестировали датчик на клеточных культурах, где он успешно обнаружил пиоцианин, вырабатываемый бактериями P. aeruginosa, и оксид азота (NO*), продуцируемый макрофагами − иммунными клетками, уничтожающими бактерии и другие опасные микроорганизмы. Также при помощи датчика удалось обнаружить влияние известного антимикробного вещества − ионов серебра (Ag+), подавляющих выработку пиоцианина бактериями.
«Следующим шагом станет использование данной технологии для исследований in vivo и мониторинга эффективности лечения ран у пациентов в клинических условиях в режиме реального времени», − отмечает профессор Стивенсон.